М. Р. Савчук1, 2, Н. В. Швед3, Н. А. Савёлов4, И. Л. Плакса2, 5
1ФГБОУ ВО «Рязанский государственный медицинский университет им. академика И. П. Павлова» Минздрава России; Россия, 390026 Рязань, ул. Высоковольтная, 9;
2ООО «Центр генетики и репродуктивной медицины «Генетико»; Россия, 119333 Москва, ул. Губкина, 3, корп. 1;
3ООО «Юним»; Россия, 121205 Москва, Большой бульвар, 42, стр. 1;
4ГБУЗ «Московская городская онкологическая больница № 62 Департамента здравоохранения г. Москвы»; Россия, Московская область, Красногорский р-н, п / о Степановское, 143423 Истра, 27;
5ГБУЗ «Ленинградский областной клинический онкологический диспансер»; Россия, 191014 Санкт-Петербург, Литейный проспект, 37
1ФГБОУ ВО «Рязанский государственный медицинский университет им. академика И. П. Павлова» Минздрава России; Россия, 390026 Рязань, ул. Высоковольтная, 9;
2ООО «Центр генетики и репродуктивной медицины «Генетико»; Россия, 119333 Москва, ул. Губкина, 3, корп. 1;
3ООО «Юним»; Россия, 121205 Москва, Большой бульвар, 42, стр. 1;
4ГБУЗ «Московская городская онкологическая больница № 62 Департамента здравоохранения г. Москвы»; Россия, Московская область, Красногорский р-н, п / о Степановское, 143423 Истра, 27;
5ГБУЗ «Ленинградский областной клинический онкологический диспансер»; Россия, 191014 Санкт-Петербург, Литейный проспект, 37
Цель исследования – выявить специфические морфологические критерии папиллярного рака щитовидной железы с транслокациями в генах NTRK.
Материалы и методы. Выполнен ретроспективный анализ 130 случаев морфологически подтвержденного папиллярного рака щитовидной железы из архива Московской городской онкологической больницы № 62 Департамента здравоохранения г. Москвы. Морфологическими критериями для проведения иммуногистохимического исследования послужили метастатическое поражение лимфатических узлов, наличие микрокальцинатов, экстратиреоидного распространения опухоли, капсулы / интратуморозных участков соединительной ткани, инвазии (в капсулу опухоли, кровеносные сосуды, лимфатические сосуды), внутриядерных псевдовключений, фолликулярного компонента в опухоли в количестве <5 %. Таким образом, были использованы все критерии рака щитовидной железы с выявленной транслокацией в генах NTRK, встречающиеся в литературе. В случае наибольшего соответствия им проводилось иммуногистохимическое исследование с антителами Ventana pan-TRK (EPR17341) Assay на иммуностейнере BenchMark Ultra, в случае положительной иммуногистохимической реакции – секвенирование нового поколения на системе высокопроизводительного полногеномного секвенирования Illumina HiSeq.
Результаты. В 10 из 130 проанализированных случаев была выявлена опухоль с гистологическими особенностями, характерными для NTRK-позитивного рака щитовидной железы. Во всех случаях заболевание отличалось индолентным течением и медленным увеличением опухоли на протяжении длительного времени. У пациента 5 опухоль щитовидной железы сочеталась с внеорганной саркомой забрюшинного пространства. Размеры опухолевого узла варьировали от 0,5 × 0,5 см до 4,0 × 3,0 см. У всех больных выявлены метастазы в лимфатические узлы, у 3 пациентов опухоль прорастала за пределы капсулы щитовидной железы. По результатам иммуногистохимического исследования в 1 из 10 случаев выявлены клетки опухоли с мутацией в генах NTRK. Цитоплазматическая экспрессия различной степени выраженности наблюдалась в 95 % опухолевых клеток. Транслокация TPM3‑NTRK1 подтверждена методом секвенирования нового поколения.
Заключение. Представленная работа демонстрирует возможность применения морфологических критериев для выявления опухолей щитовидной железы с мутациями в генах NTRK. В случае более обширной выборки можно определить особенности строения опухолей с мутациями в данных генах. Это позволит уточнить морфологические критерии и увеличить вероятность выявления мутации, что очень важно при выборе методов лечения (назначении таргетной терапии).
Ключевые слова: папиллярный рак щитовидной железы, гены NTRK, TPM3‑NTRK1
Для цитирования: Савчук М . Р., Швед Н. В., Савёлов Н. А., Плакса И. Л . Папиллярный рак щитовидной железы с транслокацией в гене TPM3‑NTRK1. Опухоли головы и шеи 2022;12(1):65–71. DOI: 10.17650/2222‑1468‑2022‑12‑1‑65‑71.
Материалы и методы. Выполнен ретроспективный анализ 130 случаев морфологически подтвержденного папиллярного рака щитовидной железы из архива Московской городской онкологической больницы № 62 Департамента здравоохранения г. Москвы. Морфологическими критериями для проведения иммуногистохимического исследования послужили метастатическое поражение лимфатических узлов, наличие микрокальцинатов, экстратиреоидного распространения опухоли, капсулы / интратуморозных участков соединительной ткани, инвазии (в капсулу опухоли, кровеносные сосуды, лимфатические сосуды), внутриядерных псевдовключений, фолликулярного компонента в опухоли в количестве <5 %. Таким образом, были использованы все критерии рака щитовидной железы с выявленной транслокацией в генах NTRK, встречающиеся в литературе. В случае наибольшего соответствия им проводилось иммуногистохимическое исследование с антителами Ventana pan-TRK (EPR17341) Assay на иммуностейнере BenchMark Ultra, в случае положительной иммуногистохимической реакции – секвенирование нового поколения на системе высокопроизводительного полногеномного секвенирования Illumina HiSeq.
Результаты. В 10 из 130 проанализированных случаев была выявлена опухоль с гистологическими особенностями, характерными для NTRK-позитивного рака щитовидной железы. Во всех случаях заболевание отличалось индолентным течением и медленным увеличением опухоли на протяжении длительного времени. У пациента 5 опухоль щитовидной железы сочеталась с внеорганной саркомой забрюшинного пространства. Размеры опухолевого узла варьировали от 0,5 × 0,5 см до 4,0 × 3,0 см. У всех больных выявлены метастазы в лимфатические узлы, у 3 пациентов опухоль прорастала за пределы капсулы щитовидной железы. По результатам иммуногистохимического исследования в 1 из 10 случаев выявлены клетки опухоли с мутацией в генах NTRK. Цитоплазматическая экспрессия различной степени выраженности наблюдалась в 95 % опухолевых клеток. Транслокация TPM3‑NTRK1 подтверждена методом секвенирования нового поколения.
Заключение. Представленная работа демонстрирует возможность применения морфологических критериев для выявления опухолей щитовидной железы с мутациями в генах NTRK. В случае более обширной выборки можно определить особенности строения опухолей с мутациями в данных генах. Это позволит уточнить морфологические критерии и увеличить вероятность выявления мутации, что очень важно при выборе методов лечения (назначении таргетной терапии).
Ключевые слова: папиллярный рак щитовидной железы, гены NTRK, TPM3‑NTRK1
Для цитирования: Савчук М . Р., Швед Н. В., Савёлов Н. А., Плакса И. Л . Папиллярный рак щитовидной железы с транслокацией в гене TPM3‑NTRK1. Опухоли головы и шеи 2022;12(1):65–71. DOI: 10.17650/2222‑1468‑2022‑12‑1‑65‑71.
Введение
Папиллярный рак щитовидной железы (ЩЖ) представляет собой опухоль из железистого эпителия, которая отличается от других морфологических вариантов рака ЩЖ образованием сосочковых структур.
Несмотря на достаточно благоприятное клиническое течение и хороший терапевтический эффект от стандартных методов лечения, встречаются новообразования, устойчивые к радиойодтерапии, и новообразования с отдаленными метастазами (в легких и головном мозге). В связи с этим интерес представляет поиск молекулярных перестроек, которые потенциально могут стать мишенью для таргетной терапии.
Одной из таких мишеней являются fusion-транслокации в генах NTRK (слияние С-концевого домена тирозинкиназы с N-концевым доменом партнера слияния, приводящее к конститутивной активации тирозинкиназы). В настоящий момент зарегистрированы 2 препарата для лечения распространенных форм рака щитовидной железы с транслокациями NTRK: ларотректиниб и энтректиниб (проникает через гематоэнцефалический барьер, что позволяет использовать его для терапии опухолей с метастазами в головном мозге).
Частота встречаемости транслокаций в генах NTRK при папиллярном раке ЩЖ невысока. Согласно данным литературы, она составляет около 2,28% [1]. Вышесказанное не позволяет рутинно использовать генетические методы исследования для выявления мутаций.
В связи с этим более предпочтительным методом является иммуногистохимическое (ИГХ) исследование, которое имеет высокие показатели чувствительности (96,9 % для транслокаций в генах NTRK1 и NTRK2 и 79,4 % для транслокаций в гене NTRK3) и специфичности (81,1%) [1]. Однако для более эффективного выявления опухолей с транслокацией в генах NTRK необходимо разработать морфологические критерии для различения новообразований с транслокациями генов NTRK от новообразований с другими молекулярными перестройками. Это позволит определить претендентов для ИГХ-исследования на этапе морфологического изучения опухоли.
Папиллярный рак щитовидной железы (ЩЖ) представляет собой опухоль из железистого эпителия, которая отличается от других морфологических вариантов рака ЩЖ образованием сосочковых структур.
Несмотря на достаточно благоприятное клиническое течение и хороший терапевтический эффект от стандартных методов лечения, встречаются новообразования, устойчивые к радиойодтерапии, и новообразования с отдаленными метастазами (в легких и головном мозге). В связи с этим интерес представляет поиск молекулярных перестроек, которые потенциально могут стать мишенью для таргетной терапии.
Одной из таких мишеней являются fusion-транслокации в генах NTRK (слияние С-концевого домена тирозинкиназы с N-концевым доменом партнера слияния, приводящее к конститутивной активации тирозинкиназы). В настоящий момент зарегистрированы 2 препарата для лечения распространенных форм рака щитовидной железы с транслокациями NTRK: ларотректиниб и энтректиниб (проникает через гематоэнцефалический барьер, что позволяет использовать его для терапии опухолей с метастазами в головном мозге).
Частота встречаемости транслокаций в генах NTRK при папиллярном раке ЩЖ невысока. Согласно данным литературы, она составляет около 2,28% [1]. Вышесказанное не позволяет рутинно использовать генетические методы исследования для выявления мутаций.
В связи с этим более предпочтительным методом является иммуногистохимическое (ИГХ) исследование, которое имеет высокие показатели чувствительности (96,9 % для транслокаций в генах NTRK1 и NTRK2 и 79,4 % для транслокаций в гене NTRK3) и специфичности (81,1%) [1]. Однако для более эффективного выявления опухолей с транслокацией в генах NTRK необходимо разработать морфологические критерии для различения новообразований с транслокациями генов NTRK от новообразований с другими молекулярными перестройками. Это позволит определить претендентов для ИГХ-исследования на этапе морфологического изучения опухоли.
Цель исследования – выявить специфические морфологические критерии папиллярного рака ЩЖ
с транслокациями в генах NTRK.
Материалы и методы
Выполнен ретроспективный анализ морфологически подтвержденного папиллярного рака ЩЖ из архива патологоанатомического отделения Московской городской онкологической больницы № 62 Департамента здравоохранения г. Москвы за период с 2016 по 2019 г. (n = 130). Для отбора кандидатов на ИГХ-исследование были выбраны морфологические критерии рака ЩЖ с выявленной транслокацией в генах NTRK, описанные в литературе [2–4].
В связи с довольно небольшой выборкой случаев определить достоверные морфологические критерии
невозможно. В ряде случаев морфологические особенности были прямо противоположны. В нашем исследовании были использованы следующие морфологические критерии: «классическое» строение папиллярного рака ЩЖ, метастатическое поражение лимфатических узлов, наличие микрокальцинатов, экстратиреоидного распространения опухоли, капсул / интратуморозных участков соединительной ткани, инвазии (в капсулу опухоли, кровеносные сосуды, лимфатические сосуды), внутриядерных псевдовключений, фолликулярного компонента в опухоли в количестве <5 %. Критериями исключения являлись онкоцитарное строение опухоли, диффузная лимфоцитарная инфильтрация, хро-
нический тиреоидит, большое количество фигур митоза.
По данным литературы, митозы в целом не характерны для новообразований с транслокацией в генах NTRK [5], а диффузная инфильтрация лимфоцитами затрудняет определение соответствия выбранным
критериям.
В случае наибольшего соответствия критериям проводилось ИГХ-исследование с антителами Ventana pan-TRK (EPR17341) Assay на иммуностейнере BenchMark Ultra, а при положительной ИГХ-реакции – секвенирование нового поколения на системе высокопроизводительного полногеномного секвенирования Illumina HiSeq со средней глубиной покрытия >500× с целью выявления однонуклеотидных замен, инсерций, делеций и изменения копийности в генах ABL1, ACVR1B, AKT1, AKT2, AKT3, ALK, ALOX12B, AMER1 (FAM123B), APC, AR, ARAF, ARFRP1, ARID1A, ASXL1, ATM, ATR, ATRX, AURKA, AURKB, AXIN1, AXL, BAP1, BARD1, BCL2, BCL2L1, BCL2L2, BCL6, BCOR, BCORL1, BRAF, BRCA1, BRCA2, BRD4, BRIP1, BTG1, BTG2, BTK, C11orf30 (EMSY), C17orf39 (GID4), CALR, CARD11, CASP8, CBFB, CBL, CCND1, CCND2, CCND3, CCNE1, CD22, CD274 (PD-L1), CD70, CD79A, CD79B, CDC73, CDH1, CDK12, CDK4, CDK6, CDK8, CDKN1A, CDKN1B, CDKN2A, CDKN2B, CDKN2C, CEBPA, CHEK1, CHEK2, CIC, CREBBP, CRKL, CSF1R, CSF3R, CTCF, CTNNA1, CTNNB1, CUL3, CUL4A, CXCR4, CYP17A1, DAXX, DDR1, DDR2, DIS3, DNMT3A, DOT1L, EED, EGFR, EP300, EPHA3, EPHB1, EPHB4, ERBB2, ERBB3, ERBB4, ERCC4, ERG, ERRFI1, ESR1, EZH2, FAM46C, FANCA, FANCC, FANCG, FANCL, FAS, FBXW7, FGF10, FGF12, FGF14, FGF19, FGF23, FGF3, FGF4, FGF6, FGFR1, FGFR2, FGFR3, FGFR4, FH, FLCN, FLT1, FLT3, FOXL2, FUBP1, GABRA6, GATA3, GATA4, GATA6, GNA11, GNA13, GNAQ, GNAS, GRM3, GSK3B, H3F3A, HDAC1, HGF, HNF1A, HRAS, HSD3B1, ID3, IDH1, IDH2, IGF1R, IKBKE, IKZF1, INPP4B, IRF2, IRF4, IRS2, JAK1, JAK2, JAK3, JUN, KDM5A, KDM5C, KDM6A, KDR, KEAP1, KEL, KIT, KLHL6, KMT2A (MLL), KMT2D (MLL2), KRAS, LTK, LYN, MAF, MAP2K1 ( MEK1), MAP2K2 (MEK2), MAP2K4, MAP3K1, MAP3K13, MAPK1, MCL1, MDM2, MDM4, MED12, MEF2B, MEN1, MERTK, MET, MITF, MKNK1, MLH1, MPL, MRE11A, MSH2, MSH3, MSH6, MST1R, MTAP, MTOR, MUTYH, MYC, MYCL (MYCL1), MYCN, MYD88, NBN, NF1, NF2, NFE2L2, NFKBIA, NKX2–1, NOTCH1, NOTCH2, NOTCH3, NPM1, NRAS, NSD3 (WHSC1L1), NT5C2, NTRK1, NTRK2, NTRK3, P2RY8, PALB2, PARK2, PARP1, PARP2, PARP3, PAX5, PBRM1, PDCD1 (PD-1), PDCD1LG2 (PD-L2), PDGFRA, PDGFRB, PDK1, PIK3C2B, PIK3C2G, PIK3CA, PIK3CB, PIK3R1, PIM1, PMS2, POLD1, POLE, PPARG, PPP2R1A, PPP2R2A, PRDM1, PRKAR1A, PRKCI, PTCH1, PTEN, PTPN11, PTPRO, QKI, RAC1, RAD21, RAD51, RAD51B, RAD51C, RAD51D, RAD52, RAD54L, RAF1, RARA, RB1, RBM10, REL, RET, RICTOR, RNF43, ROS1, RPTOR, SDHA, SDHB, SDHC, SDHD, SETD2, SF3B1, SGK1, SMAD2, SMAD4, SMARCA4, SMARCB1, SMO, SNCAIP, SOCS1, SOX2, SOX9, SPEN, SPOP, SRC, STAG2, STAT3, STK11, SUFU, SYK, TBX3, TEK, TET2, TGFBR2, TIPARP, TNFAIP3, TNFRSF14, TP53, TSC1, TSC2, TYRO3, U2AF1, VEGFA, VHL, WHSC1, WT1, XPO1, а также транслокаций в генах ALK, BCL2, BCR, BRAF, BRCA1, BRCA2, CD74, EGFR, ETV4, ETV5, ETV6, EWSR1, EZR, FGFR1, FGFR2, FGFR3, KIT, KMT2A (MLL), MSH2, MYB, MYC, NOTCH2, NTRK1, NTRK2, NUTM1, PDGFRA, RAF1, RARA, RET, ROS1, RSPO2, SDC4, SLC34A2, TERC, TERT, TMPRSS2.
с транслокациями в генах NTRK.
Материалы и методы
Выполнен ретроспективный анализ морфологически подтвержденного папиллярного рака ЩЖ из архива патологоанатомического отделения Московской городской онкологической больницы № 62 Департамента здравоохранения г. Москвы за период с 2016 по 2019 г. (n = 130). Для отбора кандидатов на ИГХ-исследование были выбраны морфологические критерии рака ЩЖ с выявленной транслокацией в генах NTRK, описанные в литературе [2–4].
В связи с довольно небольшой выборкой случаев определить достоверные морфологические критерии
невозможно. В ряде случаев морфологические особенности были прямо противоположны. В нашем исследовании были использованы следующие морфологические критерии: «классическое» строение папиллярного рака ЩЖ, метастатическое поражение лимфатических узлов, наличие микрокальцинатов, экстратиреоидного распространения опухоли, капсул / интратуморозных участков соединительной ткани, инвазии (в капсулу опухоли, кровеносные сосуды, лимфатические сосуды), внутриядерных псевдовключений, фолликулярного компонента в опухоли в количестве <5 %. Критериями исключения являлись онкоцитарное строение опухоли, диффузная лимфоцитарная инфильтрация, хро-
нический тиреоидит, большое количество фигур митоза.
По данным литературы, митозы в целом не характерны для новообразований с транслокацией в генах NTRK [5], а диффузная инфильтрация лимфоцитами затрудняет определение соответствия выбранным
критериям.
В случае наибольшего соответствия критериям проводилось ИГХ-исследование с антителами Ventana pan-TRK (EPR17341) Assay на иммуностейнере BenchMark Ultra, а при положительной ИГХ-реакции – секвенирование нового поколения на системе высокопроизводительного полногеномного секвенирования Illumina HiSeq со средней глубиной покрытия >500× с целью выявления однонуклеотидных замен, инсерций, делеций и изменения копийности в генах ABL1, ACVR1B, AKT1, AKT2, AKT3, ALK, ALOX12B, AMER1 (FAM123B), APC, AR, ARAF, ARFRP1, ARID1A, ASXL1, ATM, ATR, ATRX, AURKA, AURKB, AXIN1, AXL, BAP1, BARD1, BCL2, BCL2L1, BCL2L2, BCL6, BCOR, BCORL1, BRAF, BRCA1, BRCA2, BRD4, BRIP1, BTG1, BTG2, BTK, C11orf30 (EMSY), C17orf39 (GID4), CALR, CARD11, CASP8, CBFB, CBL, CCND1, CCND2, CCND3, CCNE1, CD22, CD274 (PD-L1), CD70, CD79A, CD79B, CDC73, CDH1, CDK12, CDK4, CDK6, CDK8, CDKN1A, CDKN1B, CDKN2A, CDKN2B, CDKN2C, CEBPA, CHEK1, CHEK2, CIC, CREBBP, CRKL, CSF1R, CSF3R, CTCF, CTNNA1, CTNNB1, CUL3, CUL4A, CXCR4, CYP17A1, DAXX, DDR1, DDR2, DIS3, DNMT3A, DOT1L, EED, EGFR, EP300, EPHA3, EPHB1, EPHB4, ERBB2, ERBB3, ERBB4, ERCC4, ERG, ERRFI1, ESR1, EZH2, FAM46C, FANCA, FANCC, FANCG, FANCL, FAS, FBXW7, FGF10, FGF12, FGF14, FGF19, FGF23, FGF3, FGF4, FGF6, FGFR1, FGFR2, FGFR3, FGFR4, FH, FLCN, FLT1, FLT3, FOXL2, FUBP1, GABRA6, GATA3, GATA4, GATA6, GNA11, GNA13, GNAQ, GNAS, GRM3, GSK3B, H3F3A, HDAC1, HGF, HNF1A, HRAS, HSD3B1, ID3, IDH1, IDH2, IGF1R, IKBKE, IKZF1, INPP4B, IRF2, IRF4, IRS2, JAK1, JAK2, JAK3, JUN, KDM5A, KDM5C, KDM6A, KDR, KEAP1, KEL, KIT, KLHL6, KMT2A (MLL), KMT2D (MLL2), KRAS, LTK, LYN, MAF, MAP2K1 ( MEK1), MAP2K2 (MEK2), MAP2K4, MAP3K1, MAP3K13, MAPK1, MCL1, MDM2, MDM4, MED12, MEF2B, MEN1, MERTK, MET, MITF, MKNK1, MLH1, MPL, MRE11A, MSH2, MSH3, MSH6, MST1R, MTAP, MTOR, MUTYH, MYC, MYCL (MYCL1), MYCN, MYD88, NBN, NF1, NF2, NFE2L2, NFKBIA, NKX2–1, NOTCH1, NOTCH2, NOTCH3, NPM1, NRAS, NSD3 (WHSC1L1), NT5C2, NTRK1, NTRK2, NTRK3, P2RY8, PALB2, PARK2, PARP1, PARP2, PARP3, PAX5, PBRM1, PDCD1 (PD-1), PDCD1LG2 (PD-L2), PDGFRA, PDGFRB, PDK1, PIK3C2B, PIK3C2G, PIK3CA, PIK3CB, PIK3R1, PIM1, PMS2, POLD1, POLE, PPARG, PPP2R1A, PPP2R2A, PRDM1, PRKAR1A, PRKCI, PTCH1, PTEN, PTPN11, PTPRO, QKI, RAC1, RAD21, RAD51, RAD51B, RAD51C, RAD51D, RAD52, RAD54L, RAF1, RARA, RB1, RBM10, REL, RET, RICTOR, RNF43, ROS1, RPTOR, SDHA, SDHB, SDHC, SDHD, SETD2, SF3B1, SGK1, SMAD2, SMAD4, SMARCA4, SMARCB1, SMO, SNCAIP, SOCS1, SOX2, SOX9, SPEN, SPOP, SRC, STAG2, STAT3, STK11, SUFU, SYK, TBX3, TEK, TET2, TGFBR2, TIPARP, TNFAIP3, TNFRSF14, TP53, TSC1, TSC2, TYRO3, U2AF1, VEGFA, VHL, WHSC1, WT1, XPO1, а также транслокаций в генах ALK, BCL2, BCR, BRAF, BRCA1, BRCA2, CD74, EGFR, ETV4, ETV5, ETV6, EWSR1, EZR, FGFR1, FGFR2, FGFR3, KIT, KMT2A (MLL), MSH2, MYB, MYC, NOTCH2, NTRK1, NTRK2, NUTM1, PDGFRA, RAF1, RARA, RET, ROS1, RSPO2, SDC4, SLC34A2, TERC, TERT, TMPRSS2.
Клинические характеристики
Проанализированы 130 случаев папиллярного рака ЩЖ. У 10 пациентов были выявлены гистологические
особенности, характерные для NTRK-позитивных опухолей. Во всех случаях заболевание отличалось индолентным течением (табл. 1) и медленным увеличением опухоли на протяжении длительного времени. Всем больным проведено радикальное хирургическое лечение. У пациента 5 опухоль ЩЖ сочеталась с внеорганной саркомой забрюшинного пространства.
Размеры опухолевого узла варьировали от 0,5 × 0,5 см до 4 × 3 см. У всех пациентов были выявлены метастазы в лимфатические узлы, у 3 больных опухоль прорастала за пределы капсулы ЩЖ (табл. 2).
Проанализированы 130 случаев папиллярного рака ЩЖ. У 10 пациентов были выявлены гистологические
особенности, характерные для NTRK-позитивных опухолей. Во всех случаях заболевание отличалось индолентным течением (табл. 1) и медленным увеличением опухоли на протяжении длительного времени. Всем больным проведено радикальное хирургическое лечение. У пациента 5 опухоль ЩЖ сочеталась с внеорганной саркомой забрюшинного пространства.
Размеры опухолевого узла варьировали от 0,5 × 0,5 см до 4 × 3 см. У всех пациентов были выявлены метастазы в лимфатические узлы, у 3 больных опухоль прорастала за пределы капсулы ЩЖ (табл. 2).
Таблица 1. Клинико-морфологическая характеристика пациентов с папиллярным раком щитовидной железы и метастазами в лимфатические узлы
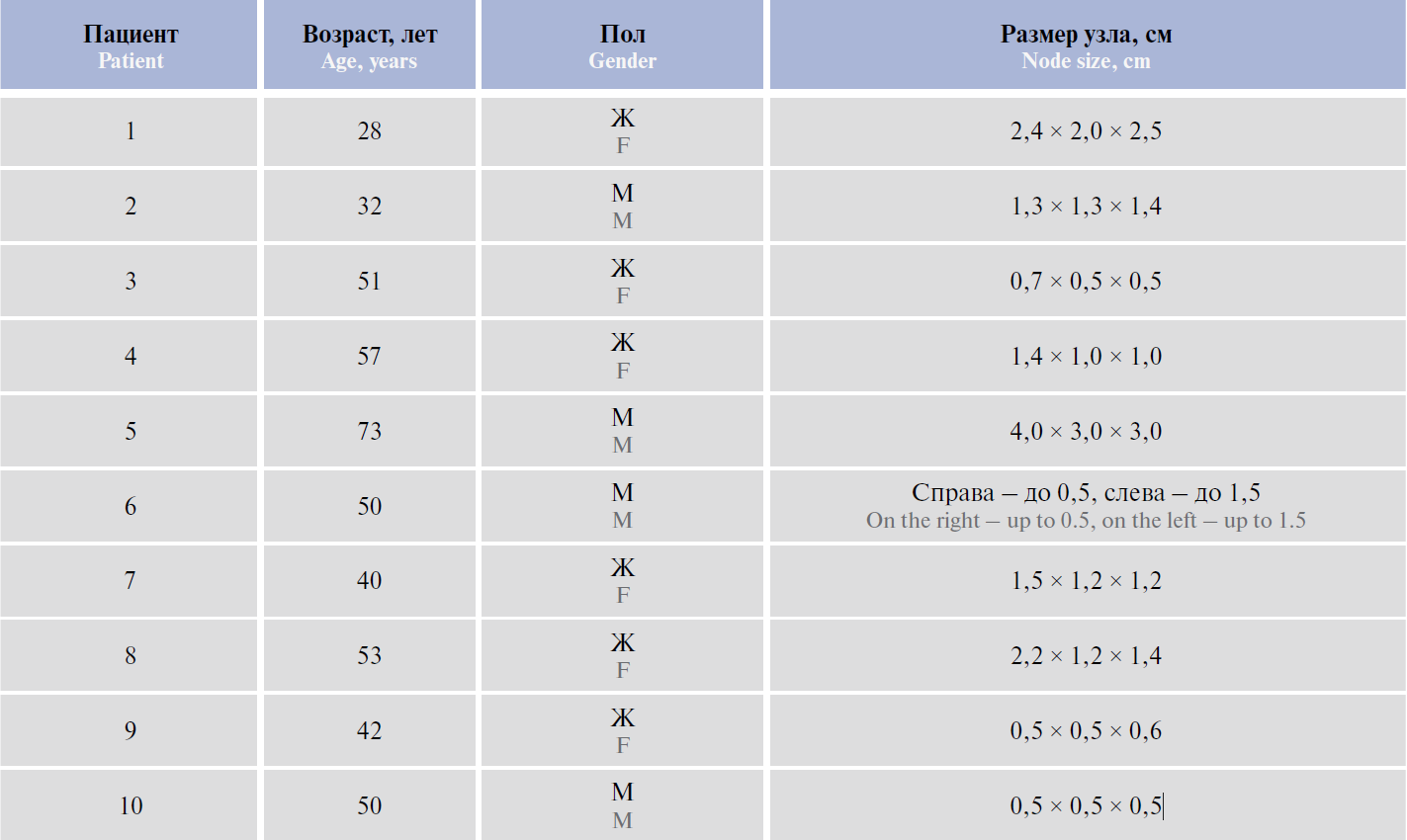
Таблица 2. Гистологическая и цитологическая характеристики опухоли у пациентов с папиллярным раком щитовидной железы
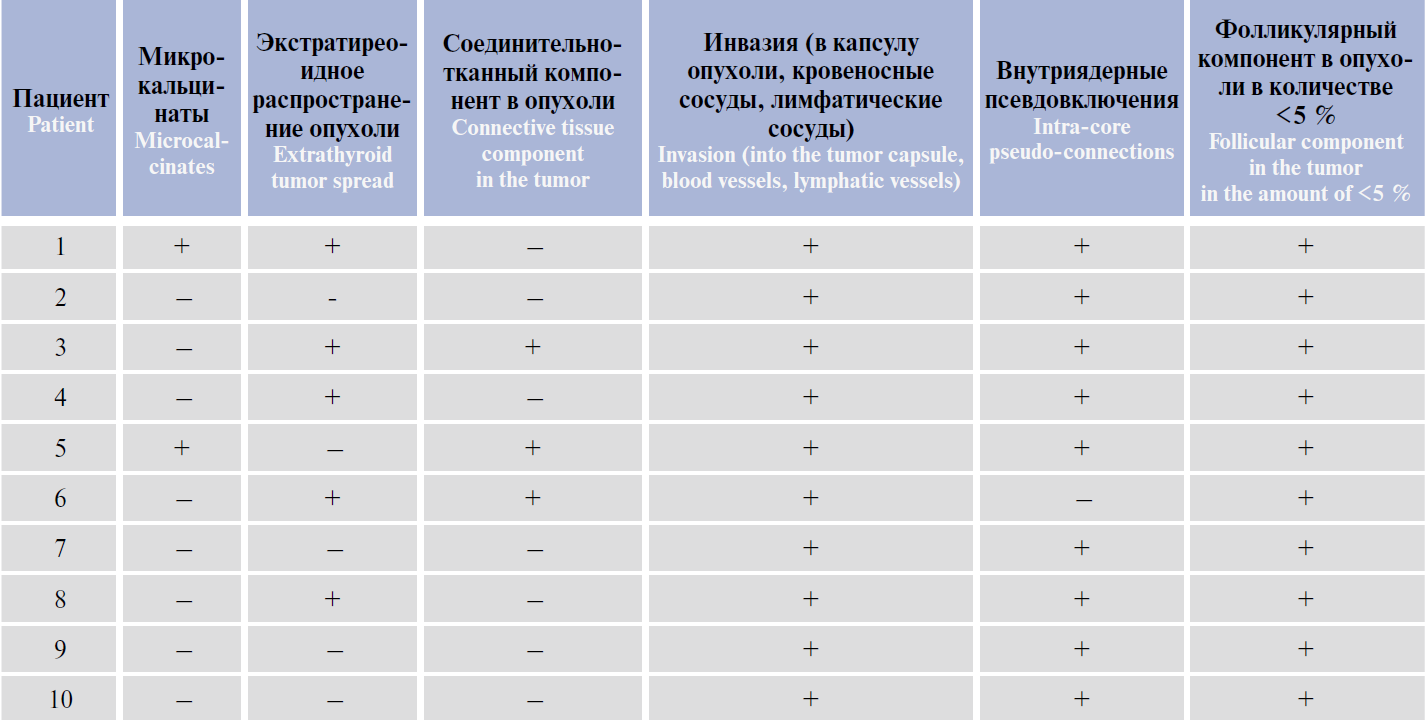
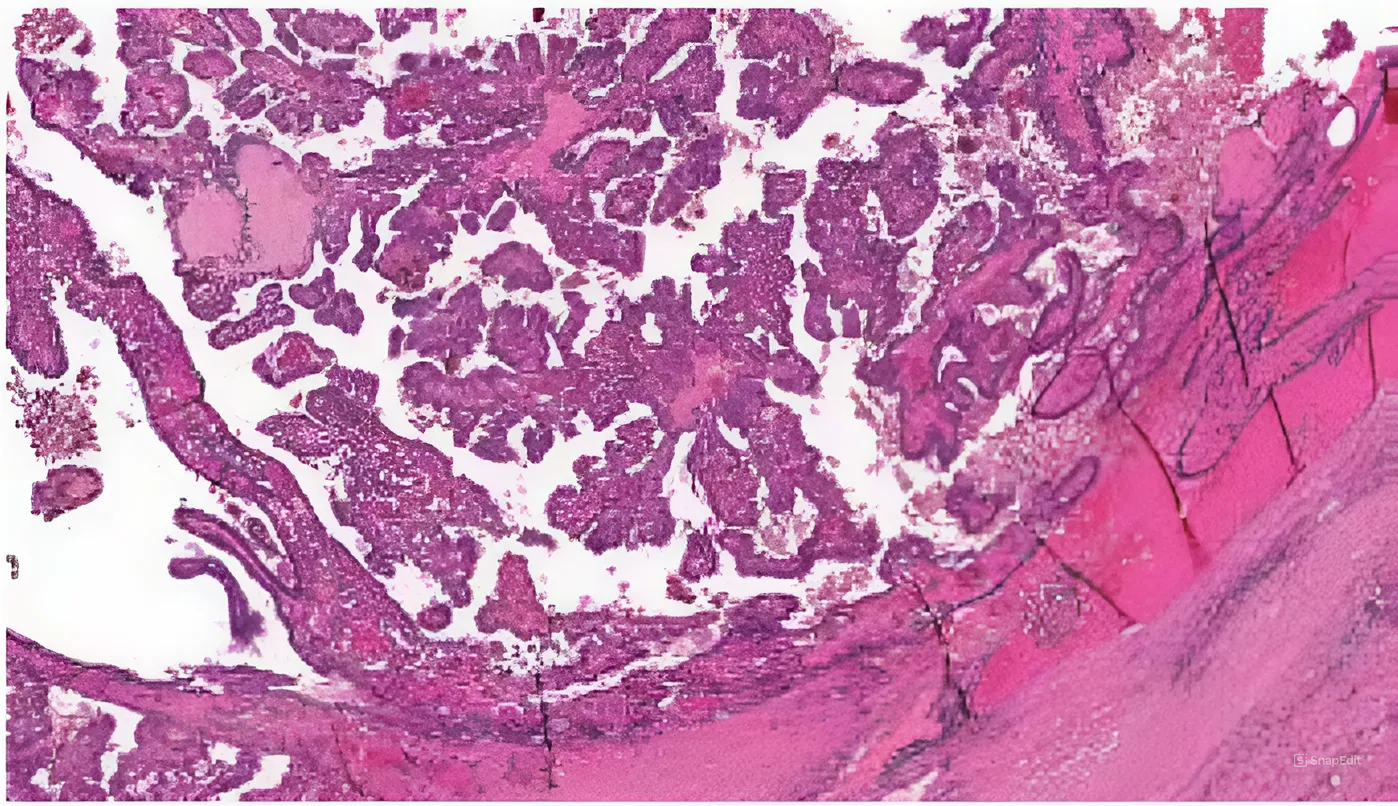
Были выявлены гистологические особенности NTRK-позитивной опухоли ЩЖ: подтверждено ее
«классическое» строение (наличие папилл малого и среднего размеров, клеток опухоли с небольшим объемом цитоплазмы без онкоцитарных изменений, базофильных ядер клеток, конденсации хроматина по
краям ядерной мембраны, клеток с ядрами по типу «притертого стекла», многочисленных эозинофильных
включений) (рис. 1, 2).
Основными гистологическими отличиями NTRK-позитивной опухоли ЩЖ, на наш взгляд, являлись
специфические изменения коллоида. Коллоид был гомогенным, плотным, с многочисленными вакуолями
различных размеров, располагающимися в основном у апикальной поверхности тироцитов. При этом на апикальной поверхности тироцитов наблюдалось скопление капель коллоида, что придавало фолликулярному эпителию некоторую фестончатость (рис. 3).
«классическое» строение (наличие папилл малого и среднего размеров, клеток опухоли с небольшим объемом цитоплазмы без онкоцитарных изменений, базофильных ядер клеток, конденсации хроматина по
краям ядерной мембраны, клеток с ядрами по типу «притертого стекла», многочисленных эозинофильных
включений) (рис. 1, 2).
Основными гистологическими отличиями NTRK-позитивной опухоли ЩЖ, на наш взгляд, являлись
специфические изменения коллоида. Коллоид был гомогенным, плотным, с многочисленными вакуолями
различных размеров, располагающимися в основном у апикальной поверхности тироцитов. При этом на апикальной поверхности тироцитов наблюдалось скопление капель коллоида, что придавало фолликулярному эпителию некоторую фестончатость (рис. 3).
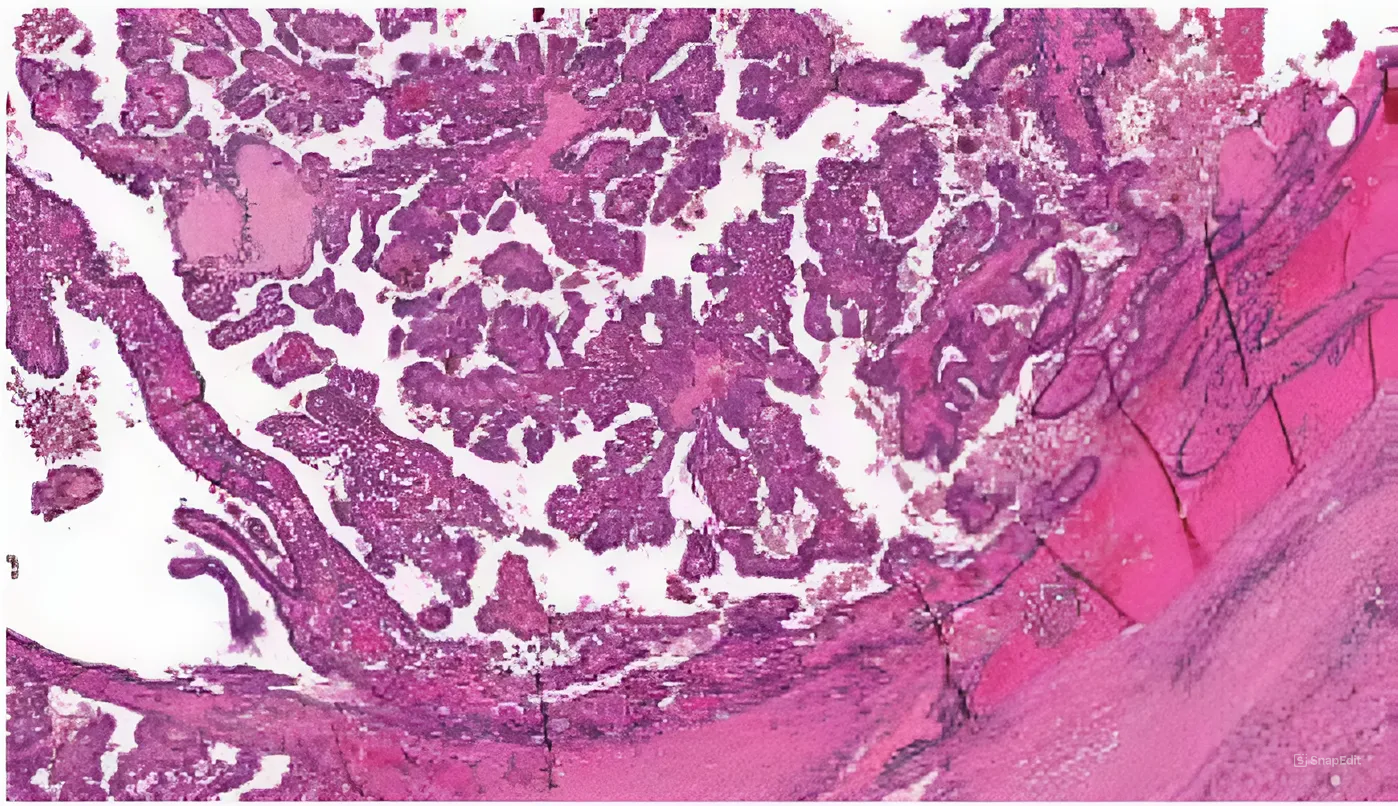
Рис. 1. Гистологическое исследование материала от пациента 5. Папиллярный рак щитовидной железы «классического» строения. Папиллярные структуры малого и среднего размеров. Окраска гематоксилином и эозином. ×100
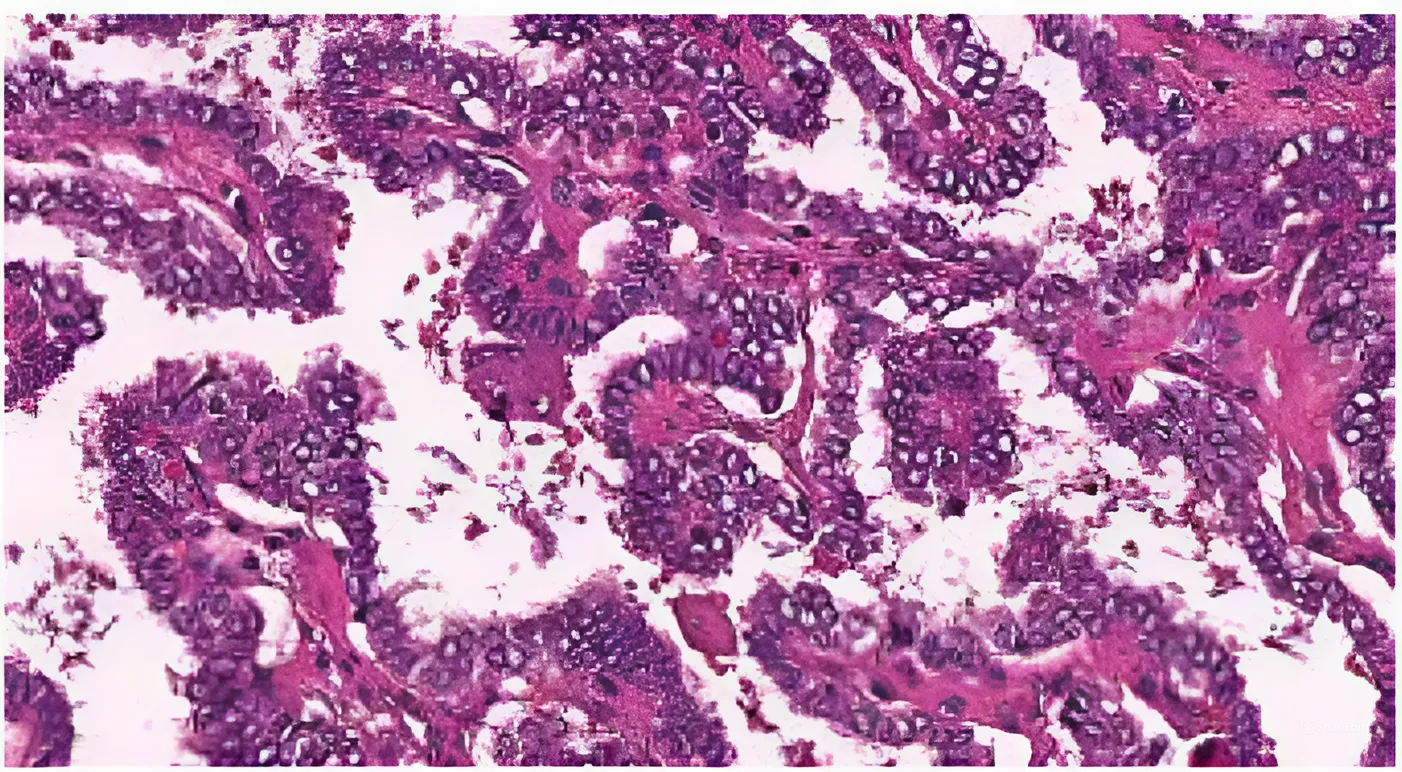
Рис. 2. Гистологическое исследование материала от пациента 5. Характерные изменения ядер клеток папиллярного рака щитовидной железы: конденсированный хроматин, внутриядерные включения, полиморфизм и напластовывание, толпление ядер. Окраска гематоксилином и эозином. ×200
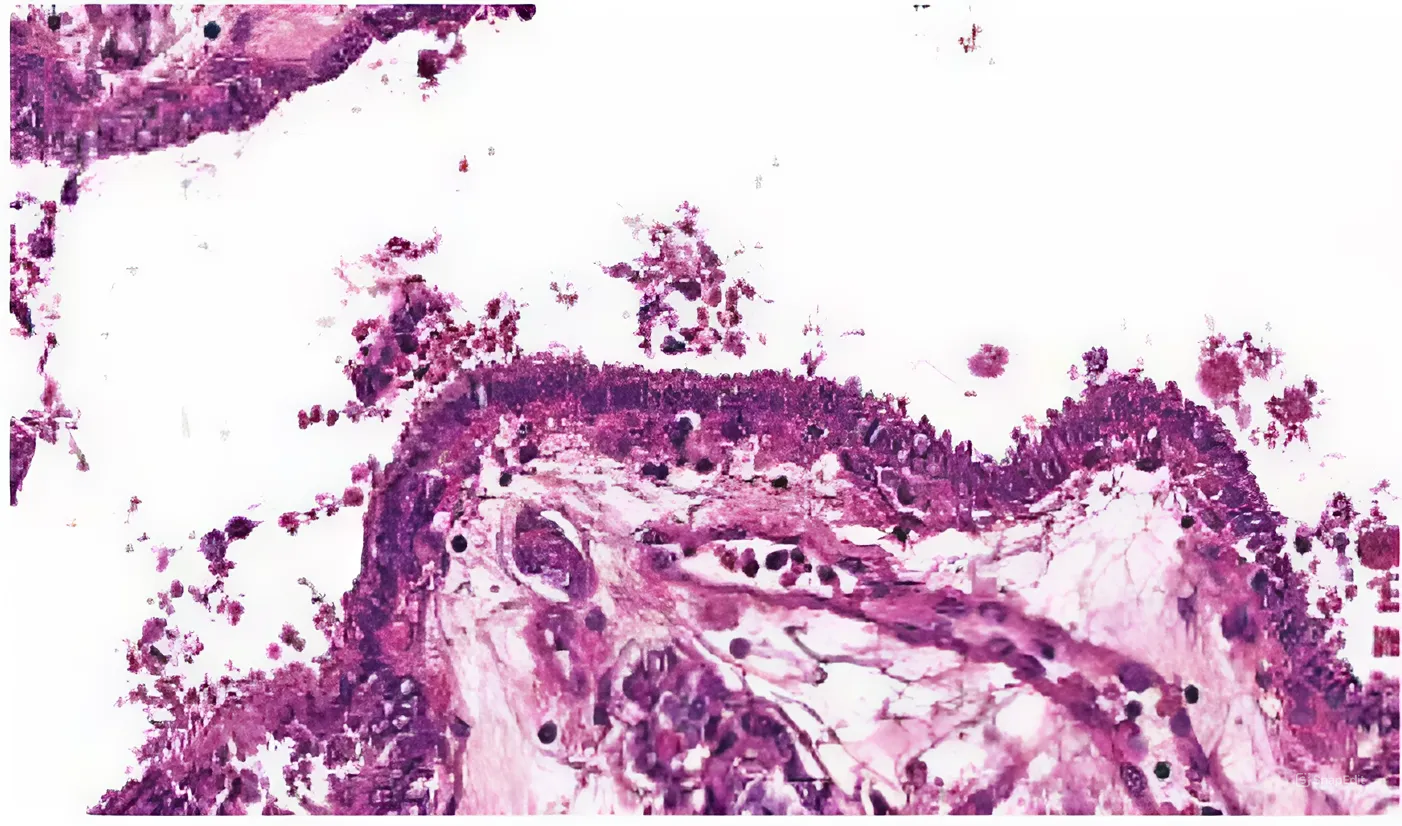
Рис. 3. Гистологическое исследование материала от пациента 5. Капликоллоида у апикальной поверхности фолликулярного эпителия, «фестончатый» вид апикальной поверхности эпителия. Окраска гематоксилином и эозином. ×300
Иммуногистохимические и молекулярно-генетические характеристики. По результатам ИГХ-исследования
в 1 из 10 случаев выявлен NTRK-позитивный рак ЩЖ. Цитоплазматическая экспрессия различной степени
выраженности наблюдалась в большей части опухолевых клеток (рис. 4). Транслокация TPM3‑NTRK1 подтверждена методом секвенирования нового поколения.
Иммуногистохимические и молекулярно-генетические характеристики. По результатам ИГХ-исследования
в 1 из 10 случаев выявлен NTRK-позитивный рак ЩЖ. Цитоплазматическая экспрессия различной степени
выраженности наблюдалась в большей части опухолевых клеток (рис. 4). Транслокация TPM3‑NTRK1 подтверждена методом секвенирования нового поколения.

Рис. 4. Гистологическое исследование материала от пациента 5. Иммуногистохимическое исследование с антителами к NTRK. Окрашивание цитоплазмы клеток опухоли различной степени выраженности. ×200
Обсуждение
Гены NTRK кодируют 3 рецепторные тирозинкиназы (Trk): A, B и C. Лиганднезависимая активация
тирозинкиназных рецепторов приводит к активизации 3 сигнальных путей – фосфоинозитидфосфолипазы Сγ (PLCγ), фосфоинозитид-3‑киназы (PI3K), митоген-активируемой протеинкиназы (MAPK), – наиболее значимым из которых является MAPK. Таким образом, мутация в генах семейства NTRK исключает мутации, активирующие те же сигнальные пути (мутации в гене BRAF, семействе генов RAS, RET и др.) [7].
В настоящий момент влияние мутаций в генах NTRK на течение заболевания и долгосрочный прогноз
изучено недостаточно в связи с довольно редкой встречаемостью этой транслокации и малым количеством исследований. Согласно данным литературы, опухоли с транлокацией в гене NTRK1 отличаются более агрессивным клиническим течением и худшим прогнозом по сравнению с опухолями с транслокацией NTRK3 [6].
Также известно, что транслокации с участием генов NTRK встречаются в новообразованиях, резистентных
к радиойодтерапии, примерно в 6,8 % случаев [8]. Согласно результатам наблюдения, без назначения специфических ингибиторов тирозинкиназы и при наличии радиойодрезистентности выживаемость пациентов с наиболее часто встречающимися транслокациями (ETV6‑NTRK3, TPM3‑NTRK1) является крайне низкой (до 2 лет) [8]. В то же время в случае отсутствия радиойодрезистентности или при лечении пациентов препаратами группы ингибиторов тирозинкиназы этот показатель значительно увеличивается (не зарегистрировано летальных исходов в течение среднего периода наблюдения 44 мес) [9]. Таким образом, несмотря на достаточно агрессивное клиническое течение со склонностью к отдаленным метастазам, персистирующему течению и возникновению рецидивов [9], в случае своевременного лечения можно достичь ремиссии заболевания.
Несмотря на то что выбранные нами случаи соответствовали тем морфологическим особенностям,
которые были описаны другими авторами, только в 1 из 10 случаев наблюдалась искомая мутация. Следовательно, можно признать вышеописанные критерии недостаточно достоверными. Их можно учитывать только в совокупности с клиническими данными и в случае исключения других мутаций, затрагивающих тот же путь, что и мутации в генах NTRK.
Таким образом, тестирование на наличие мутаций в генах NTRK необходимо проводить в случае отсутствия мутаций в генах BRAF, RAS, RET, эффекта от стандартной терапии, наличия радиойодрезистентности, агрессивного течения рака ЩЖ с отдаленными метастазами и экстратиреоидным распространением, а также если наблюдаются такие морфологические особенности,
как «классическое» строение опухоли, присутствие внутриядерных псевдовключений, капсулы, микрокальцинатов, специфических изменений коллоида, преимущественно папиллярный паттерн роста опухоли.
Гены NTRK кодируют 3 рецепторные тирозинкиназы (Trk): A, B и C. Лиганднезависимая активация
тирозинкиназных рецепторов приводит к активизации 3 сигнальных путей – фосфоинозитидфосфолипазы Сγ (PLCγ), фосфоинозитид-3‑киназы (PI3K), митоген-активируемой протеинкиназы (MAPK), – наиболее значимым из которых является MAPK. Таким образом, мутация в генах семейства NTRK исключает мутации, активирующие те же сигнальные пути (мутации в гене BRAF, семействе генов RAS, RET и др.) [7].
В настоящий момент влияние мутаций в генах NTRK на течение заболевания и долгосрочный прогноз
изучено недостаточно в связи с довольно редкой встречаемостью этой транслокации и малым количеством исследований. Согласно данным литературы, опухоли с транлокацией в гене NTRK1 отличаются более агрессивным клиническим течением и худшим прогнозом по сравнению с опухолями с транслокацией NTRK3 [6].
Также известно, что транслокации с участием генов NTRK встречаются в новообразованиях, резистентных
к радиойодтерапии, примерно в 6,8 % случаев [8]. Согласно результатам наблюдения, без назначения специфических ингибиторов тирозинкиназы и при наличии радиойодрезистентности выживаемость пациентов с наиболее часто встречающимися транслокациями (ETV6‑NTRK3, TPM3‑NTRK1) является крайне низкой (до 2 лет) [8]. В то же время в случае отсутствия радиойодрезистентности или при лечении пациентов препаратами группы ингибиторов тирозинкиназы этот показатель значительно увеличивается (не зарегистрировано летальных исходов в течение среднего периода наблюдения 44 мес) [9]. Таким образом, несмотря на достаточно агрессивное клиническое течение со склонностью к отдаленным метастазам, персистирующему течению и возникновению рецидивов [9], в случае своевременного лечения можно достичь ремиссии заболевания.
Несмотря на то что выбранные нами случаи соответствовали тем морфологическим особенностям,
которые были описаны другими авторами, только в 1 из 10 случаев наблюдалась искомая мутация. Следовательно, можно признать вышеописанные критерии недостаточно достоверными. Их можно учитывать только в совокупности с клиническими данными и в случае исключения других мутаций, затрагивающих тот же путь, что и мутации в генах NTRK.
Таким образом, тестирование на наличие мутаций в генах NTRK необходимо проводить в случае отсутствия мутаций в генах BRAF, RAS, RET, эффекта от стандартной терапии, наличия радиойодрезистентности, агрессивного течения рака ЩЖ с отдаленными метастазами и экстратиреоидным распространением, а также если наблюдаются такие морфологические особенности,
как «классическое» строение опухоли, присутствие внутриядерных псевдовключений, капсулы, микрокальцинатов, специфических изменений коллоида, преимущественно папиллярный паттерн роста опухоли.
Заключение
Представленная работа демонстрирует важность более подробного изучения морфологических характеристик папиллярного рака ЩЖ с транслокацией в генах NTRK и возможность использования вышеописанных критериев в клинической практике. В случае более обширной выборки можно определить большее количество специфических морфологических особенностей строения опухолей с мутациями в генах NTRK.
Это позволит разработать морфологические критерии, что увеличит вероятность выявления мутации и назначения специфической таргетной терапии.
Представленная работа демонстрирует важность более подробного изучения морфологических характеристик папиллярного рака ЩЖ с транслокацией в генах NTRK и возможность использования вышеописанных критериев в клинической практике. В случае более обширной выборки можно определить большее количество специфических морфологических особенностей строения опухолей с мутациями в генах NTRK.
Это позволит разработать морфологические критерии, что увеличит вероятность выявления мутации и назначения специфической таргетной терапии.
Л И Т Е Р А Т У Р А
1. Solomon J.P., Linkov I., Rosado A. et al. NTRK fusion detection across multiple assays and 33,997 cases: diagnostic implications and pitfalls. Mod Pathol 2020;33(1):38–46. DOI: 10.1038/s41379-019-0324-7.
2. Leeman-Neill R.J., Kelly L.M., Liu P. et al. ETV6-NTRK3 is a common chromosomal rearrangement
in radiationassociated thyroid cancer. Cancer 2014;120(6):799–807. DOI: 10.1002/cncr.28484.
3. Seethala R.R., Chiosea S.I., Liu C.Z. et al. Clinical and morphologic features of ETV6-NTRK3 translocated papillary thyroid carcinoma in an adult population without radiation exposure. Am J Surg Pathol 2017;41(4):446–57. DOI: 10.1097/PAS.0000000000000814.
4. Prasad M.L., Vyas M., Horne M.J. et al. NTRK fusion oncogenes in pediatric papillary thyroid carcinoma in northeast United States. Cancer 2016;122(7):1097–107. DOI: 10.1002/cncr.29887.
5. Dettloff J., Seethala R.R., Stevens T.M. et al. Mammary analog secretory carcinoma (MASC) involving the thyroid gland: a report of the first 3 cases. Head Neck Pathol 2017;11(2):124–30. DOI: 10.1007/s12105-016-0741-6.
6. Pekova B., Sykorova V., Mastnikova K. et al. NTRK fusion genes in thyroid carcinomas: clinicopathological
characteristics and their impacts on prognosis. Cancers (Basel) 2021;13(8):1932. DOI: 10.3390/cancers13081932.
7. Cancer Genome Atlas Research Network. Integrated genomic characterization of papillary thyroid carcinoma. Cell 2014;159(3):676–90. DOI: 10.1016/j.cell.2014.09.050.
8. Van der Tuin K., Ventayol Garcia M., Corver W.E. et al. Targetable gene fusions identified in radioactive
iodine refractory advanced thyroid carcinoma. Eur J Endocrinol 2019;180(4):235–41. DOI: 10.1530/EJE-18-0653.
9. Chu Y.H., Dias-Santagata D., Farahani A.A. et al. Clinicopathologic and molecular characterization
of NTRK-rearranged thyroid carcinoma (NRTC). Mod Pathol 2020;33(11):2186–97. DOI: 10.1038/s41379-020-0574-4.
2. Leeman-Neill R.J., Kelly L.M., Liu P. et al. ETV6-NTRK3 is a common chromosomal rearrangement
in radiationassociated thyroid cancer. Cancer 2014;120(6):799–807. DOI: 10.1002/cncr.28484.
3. Seethala R.R., Chiosea S.I., Liu C.Z. et al. Clinical and morphologic features of ETV6-NTRK3 translocated papillary thyroid carcinoma in an adult population without radiation exposure. Am J Surg Pathol 2017;41(4):446–57. DOI: 10.1097/PAS.0000000000000814.
4. Prasad M.L., Vyas M., Horne M.J. et al. NTRK fusion oncogenes in pediatric papillary thyroid carcinoma in northeast United States. Cancer 2016;122(7):1097–107. DOI: 10.1002/cncr.29887.
5. Dettloff J., Seethala R.R., Stevens T.M. et al. Mammary analog secretory carcinoma (MASC) involving the thyroid gland: a report of the first 3 cases. Head Neck Pathol 2017;11(2):124–30. DOI: 10.1007/s12105-016-0741-6.
6. Pekova B., Sykorova V., Mastnikova K. et al. NTRK fusion genes in thyroid carcinomas: clinicopathological
characteristics and their impacts on prognosis. Cancers (Basel) 2021;13(8):1932. DOI: 10.3390/cancers13081932.
7. Cancer Genome Atlas Research Network. Integrated genomic characterization of papillary thyroid carcinoma. Cell 2014;159(3):676–90. DOI: 10.1016/j.cell.2014.09.050.
8. Van der Tuin K., Ventayol Garcia M., Corver W.E. et al. Targetable gene fusions identified in radioactive
iodine refractory advanced thyroid carcinoma. Eur J Endocrinol 2019;180(4):235–41. DOI: 10.1530/EJE-18-0653.
9. Chu Y.H., Dias-Santagata D., Farahani A.A. et al. Clinicopathologic and molecular characterization
of NTRK-rearranged thyroid carcinoma (NRTC). Mod Pathol 2020;33(11):2186–97. DOI: 10.1038/s41379-020-0574-4.