Е.В. Гребенкин1, 2, А.А. Кошмелёв3, П. Моно3, Е.О. Баранова3, П.А. Попов3, Д.П. Атаян3, Д.Г. Пасечник1, К.А. Павлов1, 4, М. Унцеско5, И.Е. Шабанова1, И.Р. Крючков1, Н.В. Швед1, А.В. Живов3
1 ООО «ЮНИМ»; Россия, 115419 Москва, ул. Орджоникидзе, 11, стр. 1А;
2 ФГАОУ ВО «Национальный исследовательский ядерный университет «МИФИ»; Россия, 115409 Москва, Каширское шоссе, 31;
3 АО «Ильинская больница»; Россия, 143421 Московская область, д. Глухово, ул. Рублевское предместье, 2, корп. 2;
4 ФГБУ «Государственный научный центр Российской Федерации – Федеральный медицинский биофизический центр им. А.И. Бурназяна Федерального медико-биологического агентства»; Россия, 123098 Москва, ул. Маршала Новикова, 23;
5 Telemark Hospital; Norway, 3710 Skien, Ulefossvegen 55
Серозные опухоли — редкие представители группы негерминогенных опухолей яичка, морфологически сходные с серозными опухолями яичников. Предоперационная диагностика данной опухоли затруднена ввиду отсутствия специфических признаков по данным клинико-инструментальных методов исследования. Гистологическая верификация серозной пограничной опухоли также является непростой задачей и требует проведения дифференциальной диагностики в первую очередь с серозной цистаденокарциномой, которая в отличие от серозной пограничной опухоли может метастазировать и в целом характеризуется худшим прогнозом. Иммуногистохимическое исследование позволяет исключить другие опухоли, имеющие похожее морфологическое строение, включая мезотелиальные опухоли. Ввиду редкой встречаемости серозных опухолей яичка имеется минимальный клинический опыт их лечения во всем мире и до сих пор не достигнуто консенсуса в отношении рекомендаций по их терапии. Выполнение радикальной орхэктомии рекомендовано пациентам с пограничной серозной опухолью.
В статье представлен клинический случай серозной пограничной папиллярной опухоли яичка с обсуждением данных литературы об инструментальных, морфологических и иммуногистохимических характеристиках этой редкой опухоли у мужчин.
1 ООО «ЮНИМ»; Россия, 115419 Москва, ул. Орджоникидзе, 11, стр. 1А;
2 ФГАОУ ВО «Национальный исследовательский ядерный университет «МИФИ»; Россия, 115409 Москва, Каширское шоссе, 31;
3 АО «Ильинская больница»; Россия, 143421 Московская область, д. Глухово, ул. Рублевское предместье, 2, корп. 2;
4 ФГБУ «Государственный научный центр Российской Федерации – Федеральный медицинский биофизический центр им. А.И. Бурназяна Федерального медико-биологического агентства»; Россия, 123098 Москва, ул. Маршала Новикова, 23;
5 Telemark Hospital; Norway, 3710 Skien, Ulefossvegen 55
Серозные опухоли — редкие представители группы негерминогенных опухолей яичка, морфологически сходные с серозными опухолями яичников. Предоперационная диагностика данной опухоли затруднена ввиду отсутствия специфических признаков по данным клинико-инструментальных методов исследования. Гистологическая верификация серозной пограничной опухоли также является непростой задачей и требует проведения дифференциальной диагностики в первую очередь с серозной цистаденокарциномой, которая в отличие от серозной пограничной опухоли может метастазировать и в целом характеризуется худшим прогнозом. Иммуногистохимическое исследование позволяет исключить другие опухоли, имеющие похожее морфологическое строение, включая мезотелиальные опухоли. Ввиду редкой встречаемости серозных опухолей яичка имеется минимальный клинический опыт их лечения во всем мире и до сих пор не достигнуто консенсуса в отношении рекомендаций по их терапии. Выполнение радикальной орхэктомии рекомендовано пациентам с пограничной серозной опухолью.
В статье представлен клинический случай серозной пограничной папиллярной опухоли яичка с обсуждением данных литературы об инструментальных, морфологических и иммуногистохимических характеристиках этой редкой опухоли у мужчин.
Ключевые слова: негерминогенная опухоль яичка, серозная опухоль яичка, серозная пограничная папиллярная опухоль, серозная опухоль яичка с овариальной стромой
Для цитирования: Гребенкин Е.В., Кошмелёв А.А., Моно П. и др. Клинический случай серозной пограничной папиллярной опухоли яичка с овариальной стромой. Онкоурология 2024;20(1):109–15.
DOI: https://doi.org/10.17650/1726-9776-2024-20-1-109-115
Для цитирования: Гребенкин Е.В., Кошмелёв А.А., Моно П. и др. Клинический случай серозной пограничной папиллярной опухоли яичка с овариальной стромой. Онкоурология 2024;20(1):109–15.
DOI: https://doi.org/10.17650/1726-9776-2024-20-1-109-115
Введение
Серозные опухоли – редкие представители группы негерминогенных опухолей яичка, морфологически сходные с серозными опухолями яичников. На сегодняшний день в литературе описано около 100 клинических случаев опухолей яичникового типа у мужчин. Наиболее частой из этой группы является серозная пограничная опухоль, которая представляет собой неинвазивное пролиферативное серозно-эпителиальное новообразование с легкой или умеренной клеточной атипией [1]. Эпителиальные опухоли яичка яичникового типа чаще всего встречаются у мужчин в возрасте 50 лет и старше. Большинство опухолей проявляют себя безболезненным увеличением мошонки или пальпируемым образованием в мошонке, иногда с сопутствующим гидроцеле. Локализация опухоли может быть как интратестикулярной, так и паратестикулярной, причем большинство паратестикулярных опухолей возникают из влагалищной оболочки или тестикуло-эпидидимальной бороздки [2].
Предоперационная диагностика этой опухоли затруднена ввиду отсутствия специфических признаков по данным клинико-инструментальных методов исследования. Однако гистологическая верификация серозной пограничной опухоли также является непростой задачей и требует проведения дифференциальной диагностики в первую очередь с серозной цистаденокарциномой, которая в отличие от серозной пограничной опухоли может метастазировать и в целом характеризуется худшим прогнозом [3]. Пограничная серозная опухоль имеет характерный иммуногистохимический профиль, что позволяет исключить другие опухоли, имеющие похожее морфологическое строение, включая мезотелиальные опухоли.
В статье представлен клинический случай серозной пограничной опухоли яичка с обсуждением данных литературы об инструментальных, морфологических и иммуногистохимических характеристиках этой редкой опухоли у мужчин.
Серозные опухоли – редкие представители группы негерминогенных опухолей яичка, морфологически сходные с серозными опухолями яичников. На сегодняшний день в литературе описано около 100 клинических случаев опухолей яичникового типа у мужчин. Наиболее частой из этой группы является серозная пограничная опухоль, которая представляет собой неинвазивное пролиферативное серозно-эпителиальное новообразование с легкой или умеренной клеточной атипией [1]. Эпителиальные опухоли яичка яичникового типа чаще всего встречаются у мужчин в возрасте 50 лет и старше. Большинство опухолей проявляют себя безболезненным увеличением мошонки или пальпируемым образованием в мошонке, иногда с сопутствующим гидроцеле. Локализация опухоли может быть как интратестикулярной, так и паратестикулярной, причем большинство паратестикулярных опухолей возникают из влагалищной оболочки или тестикуло-эпидидимальной бороздки [2].
Предоперационная диагностика этой опухоли затруднена ввиду отсутствия специфических признаков по данным клинико-инструментальных методов исследования. Однако гистологическая верификация серозной пограничной опухоли также является непростой задачей и требует проведения дифференциальной диагностики в первую очередь с серозной цистаденокарциномой, которая в отличие от серозной пограничной опухоли может метастазировать и в целом характеризуется худшим прогнозом [3]. Пограничная серозная опухоль имеет характерный иммуногистохимический профиль, что позволяет исключить другие опухоли, имеющие похожее морфологическое строение, включая мезотелиальные опухоли.
В статье представлен клинический случай серозной пограничной опухоли яичка с обсуждением данных литературы об инструментальных, морфологических и иммуногистохимических характеристиках этой редкой опухоли у мужчин.
Клинический случай
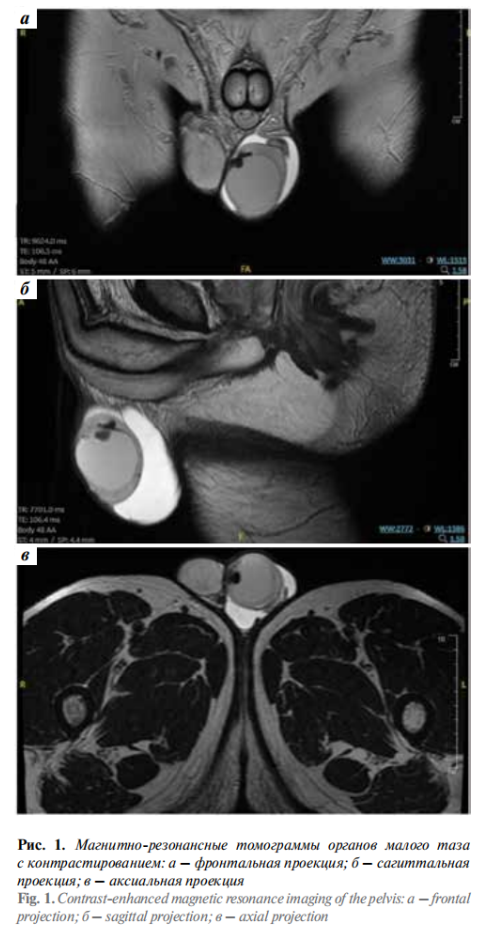
Пациент, 68 лет, самостоятельно обнаружил увеличение в размере левого яичка, в связи с чем обратился к урологу. После физикального осмотра было подтверждено наличие неоднородной плотной опухолевой массы в левой половине мошонки. Пациенту была выполнена магнитно-резонансная томография органов малого таза с контрастированием (рис. 1). Результат: правое яичко не изменено, левое увеличено до 45 × 42 × 57 мм за счет расположенного центрально интратестикулярного кистозного однокамерного образования, неизмененная паренхима яичка оттеснена к периферии и неравномерно истончена от 1 до 8 мм. Кистозное образование, заполненное высокобелковым жидкостным содержимым, с четким неровным контуром, с неравномерно утолщенной капсулой за счет пристеночных геморрагических включений и кальцинатов по внутренней и наружной поверхности.
По внутренней поверхности капсулы образования определялись контрастирующиеся солидные узелки: по задней полуокружности размерами до 5 мм, по медиальной полуокружности размерами до 8 мм. Ограничения диффузии в образовании не выявлено. Белочная оболочка яичка сохранена, определялась отчетливо на всем протяжении.
Придаток левого яичка не изменен. Отмечалось избыточное скопление гомогенной жидкости в левой половине мошонки между слоями влагалищной оболочки. Увеличения тазовых лимфатических узлов не выявлено.
При лабораторном исследовании уровней онкомаркеров, таких как альфа-фетопротеин (АФП), хорионический гонадотропин человека (ХГЧ) и лактатдегидрогеназа, отклонений от нормы не выявлено.
Пациент был госпитализирован в урологическое отделение Ильинской больницы, где ему выполнена радикальная орхэктомия слева стандартным надпаховым доступом, без технических трудностей. Послеоперационный период протекал без осложнений. Пациент был выписан через 18 ч после проведения вмешательства под динамическое наблюдение онкоуролога.
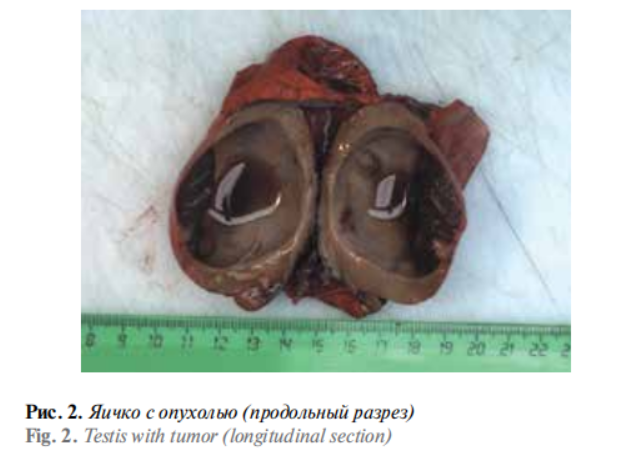
Операционный материал поступил в патоморфологическую лабораторию ООО «ЮНИМ». Результат макроскопического исследования: препарат – левое яичко с придатком, оболочками и семенным канатиком, размером 100 × 70 × 50 мм. После вскрытия тонкой прозрачной влагалищной оболочки выделилось 24 мл серозной жидкости. На разрезе в толще паренхимы яичка - кистозное образование размером 45 × 45 × 45 мм, заполненное слизистым содержимым коричневатого цвета (рис. 2). Стенка кисты на большем протяжении гладкая, однако обнаружены очаги с сосочковыми выростами серого цвета максимальным размером 10 × 7 мм, высотой до 4 мм. Придаток яичка визуально не был вовлечен в опухолевый процесс. Вырезка операционного материала осуществлялась согласно протоколу Колледжа американских патологоанатомов [4].
Пациент, 68 лет, самостоятельно обнаружил увеличение в размере левого яичка, в связи с чем обратился к урологу. После физикального осмотра было подтверждено наличие неоднородной плотной опухолевой массы в левой половине мошонки. Пациенту была выполнена магнитно-резонансная томография органов малого таза с контрастированием (рис. 1). Результат: правое яичко не изменено, левое увеличено до 45 × 42 × 57 мм за счет расположенного центрально интратестикулярного кистозного однокамерного образования, неизмененная паренхима яичка оттеснена к периферии и неравномерно истончена от 1 до 8 мм. Кистозное образование, заполненное высокобелковым жидкостным содержимым, с четким неровным контуром, с неравномерно утолщенной капсулой за счет пристеночных геморрагических включений и кальцинатов по внутренней и наружной поверхности.
По внутренней поверхности капсулы образования определялись контрастирующиеся солидные узелки: по задней полуокружности размерами до 5 мм, по медиальной полуокружности размерами до 8 мм. Ограничения диффузии в образовании не выявлено. Белочная оболочка яичка сохранена, определялась отчетливо на всем протяжении.
Придаток левого яичка не изменен. Отмечалось избыточное скопление гомогенной жидкости в левой половине мошонки между слоями влагалищной оболочки. Увеличения тазовых лимфатических узлов не выявлено.
При лабораторном исследовании уровней онкомаркеров, таких как альфа-фетопротеин (АФП), хорионический гонадотропин человека (ХГЧ) и лактатдегидрогеназа, отклонений от нормы не выявлено.
Пациент был госпитализирован в урологическое отделение Ильинской больницы, где ему выполнена радикальная орхэктомия слева стандартным надпаховым доступом, без технических трудностей. Послеоперационный период протекал без осложнений. Пациент был выписан через 18 ч после проведения вмешательства под динамическое наблюдение онкоуролога.
Операционный материал поступил в патоморфологическую лабораторию ООО «ЮНИМ». Результат макроскопического исследования: препарат – левое яичко с придатком, оболочками и семенным канатиком, размером 100 × 70 × 50 мм. После вскрытия тонкой прозрачной влагалищной оболочки выделилось 24 мл серозной жидкости. На разрезе в толще паренхимы яичка - кистозное образование размером 45 × 45 × 45 мм, заполненное слизистым содержимым коричневатого цвета (рис. 2). Стенка кисты на большем протяжении гладкая, однако обнаружены очаги с сосочковыми выростами серого цвета максимальным размером 10 × 7 мм, высотой до 4 мм. Придаток яичка визуально не был вовлечен в опухолевый процесс. Вырезка операционного материала осуществлялась согласно протоколу Колледжа американских патологоанатомов [4].
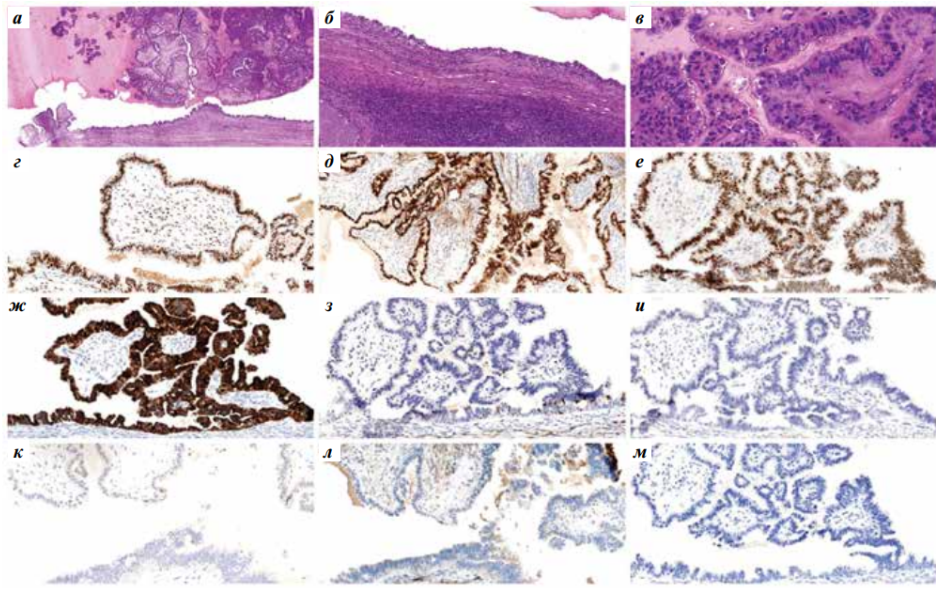
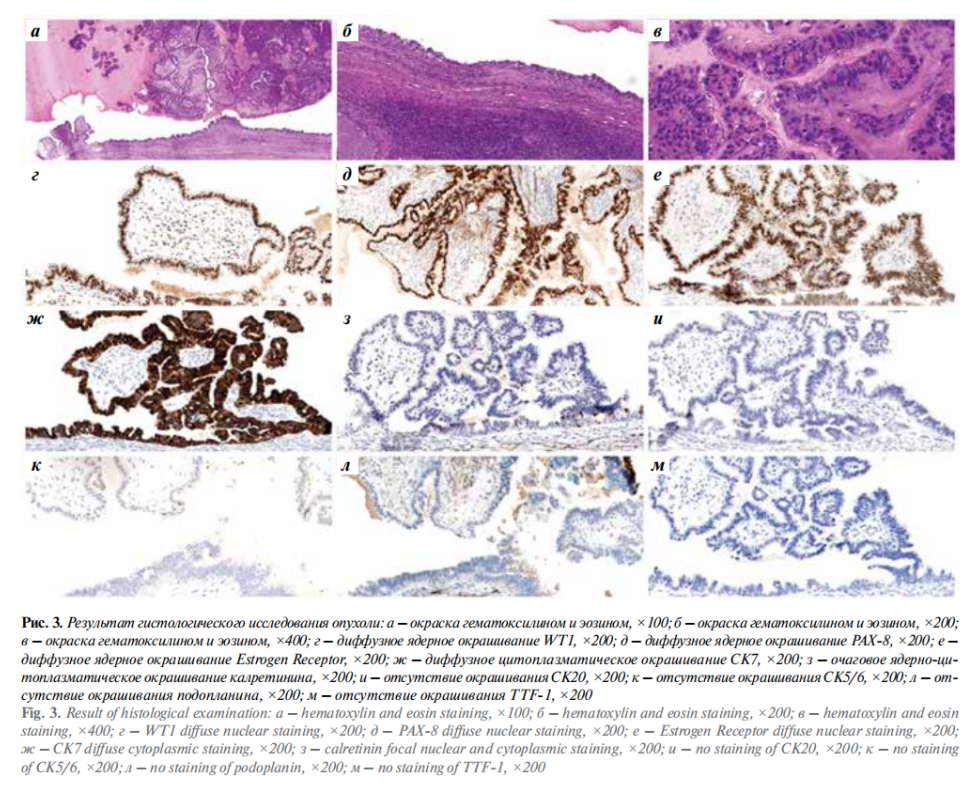
Выполнена оценка гистологических препаратов, окрашенных гематоксилином и эозином (рис. 3, а–в). Опухоль в толще паренхимы яичка представлена кистозным образованием, в просвете которого определяются эозинофильные гомогенные массы с отложениями кристаллов холестерина, а также разрастания сосочковых ветвящихся структур, в основе которых фиброзная строма с гиалинозом и миксоидизацией. Стенки кисты и сосочки выстланы цилиндрическими и кубическими опухолевыми клетками с умеренно выраженным ядерным полиморфизмом, с невысокой митотической активностью (до 3 митозов в 10 больших полях зрения). В стенке кистозного образования определяются очаговые скопления гемосидерофагов, лимфоцитов, гистиоцитов, кристаллов холестерина, кальцинатов, а также небольшие кистозные структуры с выстилкой, цитологически аналогичной выстилке в основной опухоли, без десмопластической реакции окружающей овариоподобной стромы.
Лимфоваскулярная и периневральная инвазия не обнаружены. Придаток яичка, оболочки яичка, семенной канатик не вовлечены в опухолевый процесс. Край резекции семенного канатика свободен от опухоли.
В целях уточнения гистологического типа опухоли было выполнено иммуногистохимическое исследование (рис. 3, г–м). В клетках опухоли определяются диффузная экспрессия WT1 (клон WT49, Leica), PAX-8 (клон polyclonal, Cell Marque), CK7 (клон RN7, Leica), Estrogen Receptor (клон SP1, Roshe), очаговая экспрессия калретинина (клон CAL6, Leica), отсутствие экспрессии TTF-1 (клон SPT24, Leica), CK20 (клон Ks20.8, Leica), CK5/6 (клон D5-16B4, Epitomics), подопланина (клон D2-40, Roshe). Индекс пролиферации Ki-67 (клон ММ1, Leica) 10 %.
Таким образом, морфологическая картина и результат иммуногистохимического исследования соответствуют серозной пограничной папиллярной опухоли левого яичка с овариальной стромой.
Лимфоваскулярная и периневральная инвазия не обнаружены. Придаток яичка, оболочки яичка, семенной канатик не вовлечены в опухолевый процесс. Край резекции семенного канатика свободен от опухоли.
В целях уточнения гистологического типа опухоли было выполнено иммуногистохимическое исследование (рис. 3, г–м). В клетках опухоли определяются диффузная экспрессия WT1 (клон WT49, Leica), PAX-8 (клон polyclonal, Cell Marque), CK7 (клон RN7, Leica), Estrogen Receptor (клон SP1, Roshe), очаговая экспрессия калретинина (клон CAL6, Leica), отсутствие экспрессии TTF-1 (клон SPT24, Leica), CK20 (клон Ks20.8, Leica), CK5/6 (клон D5-16B4, Epitomics), подопланина (клон D2-40, Roshe). Индекс пролиферации Ki-67 (клон ММ1, Leica) 10 %.
Таким образом, морфологическая картина и результат иммуногистохимического исследования соответствуют серозной пограничной папиллярной опухоли левого яичка с овариальной стромой.
Обсуждение
Серозные опухоли яичка встречаются очень редко. В отличие от таковых опухолей у женщин, у которых серозные карциномы высокой степени злокачественности представляют собой наиболее распространенный тип, у мужчин наиболее распространенным подтипом являются серозные пограничные опухоли [5].
Патогенез серозных опухолей яичка до сих пор остается предметом дискуссии, однако выделяют 2 основные гипотезы, включающие происхождение опухоли из эмбриологических остатков мюллеровых протоков и в результате мюллеровой метаплазии мезотелия влагалищной оболочки [6, 7].
Диагностика серозной пограничной опухоли на дооперационном этапе затруднена. Для данной опухоли не характерны специфические изменения лабораторных показателей, включая повышение уровней АФП и ХГЧ крови, что наблюдается при герминогенных опухолях [8]. Ультразвуковая картина серозной пограничной опухоли не является специфичной, и может потребоваться применение дополнительных методов визуализации. В работе A. Hsieh и соавт. магнитно-резонансное исследование продемонстрировало гиперинтенсивность на Т2-взвешенных изображениях с ветвевидным узловым периферическим усилением в серозной пограничной опухоли яичка.
При этом авторы отмечают, что семиномы обычно изоинтенсивны на изображениях, взвешенных по протонной плотности, и гипоинтенсивны и однородны на Т2-взвешенных изображениях. Несеминомные герминогенные опухоли характеризуются заметной гетерогенностью и переменной интенсивностью как на изображениях, взвешенных по протонной плотности, так и на Т2-взвешенных изображениях [8, 9].
С учетом отсутствия убедительных и достоверных признаков серозной пограничной опухоли по данным клинико-инструментальных методов исследования гистологическое исследование является «золотым стандартом» диагностики этой опухоли. Гистологическое строение серозной пограничной опухоли яичка сходно со строением одноименной опухоли яичника и характеризуется наличием сосочковых структур с неправильным иерархическим ветвлением, выстланных многослойным реснитчатым столбчатым эпителием с клеточной атипией от легкой до умеренной степени, с заметными ядрышками и редкими фигурами митозов. Интратестикулярные опухоли, как правило, имеют кистозное строение, отграничены от окружающей паренхимы фиброзной капсулой и содержат в просвете серозную жидкость [1]. При этом наличие выраженной клеточной атипии, некроза и/или стромальной инвазии свидетельствует в пользу инвазивной серозной карциномы. Тщательное гистологическое исследование образцов серозной пограничной опухоли имеет важное значение, поскольку наличие инвазии увеличивает вероятность возникновения рецидива и метастазов. В представленном нами случае морфологическое строение опухоли соответствует классическому описанию серозной пограничной опухоли.
В сомнительных случаях иммуногистохимическое исследование позволяет уточнить гистологический тип
опухоли и провести дифференциальный диагноз с другими новообразованиями, включая мезотелиальные опухоли. Для серозной пограничной опухоли яичка характерны наличие окрашивания в клетках опухоли
таких иммуногистохимических маркеров, как WT1, PAX-8, BerEP4, ER, PR, CA125, CEA, CK5/6 и CK7, а также низкие показатели индекса Ki-67 [1, 7, 10, 11], в то время как в опухолях мезотелиального происхождения определяется окрашивание калретинина, подопланина и тромбомодулина. Также следует включать в дифференциально-диагностический ряд редко встречающуюся аденокарциному сети яичка, для которой не характерны кистозное строение и наличие сосочковых структур.
Протоонкоген BRAF кодирует активатор сигнального пути митоген-активируемой протеинкиназы (MAPK), который участвует в росте и дифференцировке тканей. Обнаружено, что мутации, затрагивающие компонент этого пути, наблюдаются более чем в половине пограничных серозных опухолей и серозных карцином низкой степени злокачественности яичников. Для этих же опухолей характерны мутации гена гомолога вирусного онкогена саркомы Кирстена (KRAS) [12]. Напротив, в опухолях высокой степени злокачественности обнаруживается мутация TP53 [13, 14]. Это привело к подразделению серозных опухолей яичников на группы низкой степени (пограничная серозная опухоль и серозная карцинома низкой степени злокачественности) и высокой степени (серозная карцинома высокой степени злокачественности) злокачественности [13, 15].
D. Cundell и соавт. первыми сообщили об обнаружении мутации BRAF в серозной пограничной опухоли яичка; мутация KRAS не была выявлена [5]. В исследовании P. Gwiti и соавт. мутации BRAF и/или KRAS обнаружены в 3 из 7 случаев, что аналогично пропорциям, зарегистрированным при серозных новообразованиях яичников низкой степени злокачественности. В 1 из этих 3 случаев наблюдалась коммутация BRAF и KRAS [7]. Данные результаты подтверждают роль аберрантной передачи сигналов пути MAPK в патогенезе серозных опухолей яичка низкой степени злокачественности аналогично одноименным опухолям яичников.
Поскольку серозные опухоли яичка и придатка являются крайне редкими, во всем мире имеется минимальный клинический опыт лечения данных опухолей, ввиду чего не достигнуто консенсуса в отношении рекомендаций по их лечению. Выполнение радикальной орхэктомии рекомендовано пациентам с пограничной серозной опухолью. Считается, что данная опухоль характеризуется благоприятным прогнозом. Не было зарегистрировано случаев метастазирования. Однако, учитывая редкую встречаемость этой опухоли у мужчин и, как следствие, невозможность формирования достоверного суждения о ее прогнозе ввиду малого количества зарегистрированных на сегодняшний день во всем мире случаев по данным доступной литературы, необходимо тщательное многолетнее наблюдение за пациентами с серозной пограничной опухолью яичка.
Заключение
Пограничные тестикулярные эпителиальные опухоли яичникового типа являются чрезвычайно редкими и недостаточно изученными. Несмотря на это, нельзя забывать об их возможном инвазивном росте и склонности к рецидиву. Этот факт должен учитываться при дифференциальной диагностике необычных кистозных поражений яичка, мезотелиом или карцином яичка. Иммуногистохимическое исследование следует признать эффективным инструментом в обнаружении данного типа опухолей. Поскольку в имеющихся руководствах нет четких рекомендаций по лечению и ведению пациентов с пограничными тестикулярными опухолями яичникового типа, важно обмениваться опытом их обнаружения и лечения.
Серозные опухоли яичка встречаются очень редко. В отличие от таковых опухолей у женщин, у которых серозные карциномы высокой степени злокачественности представляют собой наиболее распространенный тип, у мужчин наиболее распространенным подтипом являются серозные пограничные опухоли [5].
Патогенез серозных опухолей яичка до сих пор остается предметом дискуссии, однако выделяют 2 основные гипотезы, включающие происхождение опухоли из эмбриологических остатков мюллеровых протоков и в результате мюллеровой метаплазии мезотелия влагалищной оболочки [6, 7].
Диагностика серозной пограничной опухоли на дооперационном этапе затруднена. Для данной опухоли не характерны специфические изменения лабораторных показателей, включая повышение уровней АФП и ХГЧ крови, что наблюдается при герминогенных опухолях [8]. Ультразвуковая картина серозной пограничной опухоли не является специфичной, и может потребоваться применение дополнительных методов визуализации. В работе A. Hsieh и соавт. магнитно-резонансное исследование продемонстрировало гиперинтенсивность на Т2-взвешенных изображениях с ветвевидным узловым периферическим усилением в серозной пограничной опухоли яичка.
При этом авторы отмечают, что семиномы обычно изоинтенсивны на изображениях, взвешенных по протонной плотности, и гипоинтенсивны и однородны на Т2-взвешенных изображениях. Несеминомные герминогенные опухоли характеризуются заметной гетерогенностью и переменной интенсивностью как на изображениях, взвешенных по протонной плотности, так и на Т2-взвешенных изображениях [8, 9].
С учетом отсутствия убедительных и достоверных признаков серозной пограничной опухоли по данным клинико-инструментальных методов исследования гистологическое исследование является «золотым стандартом» диагностики этой опухоли. Гистологическое строение серозной пограничной опухоли яичка сходно со строением одноименной опухоли яичника и характеризуется наличием сосочковых структур с неправильным иерархическим ветвлением, выстланных многослойным реснитчатым столбчатым эпителием с клеточной атипией от легкой до умеренной степени, с заметными ядрышками и редкими фигурами митозов. Интратестикулярные опухоли, как правило, имеют кистозное строение, отграничены от окружающей паренхимы фиброзной капсулой и содержат в просвете серозную жидкость [1]. При этом наличие выраженной клеточной атипии, некроза и/или стромальной инвазии свидетельствует в пользу инвазивной серозной карциномы. Тщательное гистологическое исследование образцов серозной пограничной опухоли имеет важное значение, поскольку наличие инвазии увеличивает вероятность возникновения рецидива и метастазов. В представленном нами случае морфологическое строение опухоли соответствует классическому описанию серозной пограничной опухоли.
В сомнительных случаях иммуногистохимическое исследование позволяет уточнить гистологический тип
опухоли и провести дифференциальный диагноз с другими новообразованиями, включая мезотелиальные опухоли. Для серозной пограничной опухоли яичка характерны наличие окрашивания в клетках опухоли
таких иммуногистохимических маркеров, как WT1, PAX-8, BerEP4, ER, PR, CA125, CEA, CK5/6 и CK7, а также низкие показатели индекса Ki-67 [1, 7, 10, 11], в то время как в опухолях мезотелиального происхождения определяется окрашивание калретинина, подопланина и тромбомодулина. Также следует включать в дифференциально-диагностический ряд редко встречающуюся аденокарциному сети яичка, для которой не характерны кистозное строение и наличие сосочковых структур.
Протоонкоген BRAF кодирует активатор сигнального пути митоген-активируемой протеинкиназы (MAPK), который участвует в росте и дифференцировке тканей. Обнаружено, что мутации, затрагивающие компонент этого пути, наблюдаются более чем в половине пограничных серозных опухолей и серозных карцином низкой степени злокачественности яичников. Для этих же опухолей характерны мутации гена гомолога вирусного онкогена саркомы Кирстена (KRAS) [12]. Напротив, в опухолях высокой степени злокачественности обнаруживается мутация TP53 [13, 14]. Это привело к подразделению серозных опухолей яичников на группы низкой степени (пограничная серозная опухоль и серозная карцинома низкой степени злокачественности) и высокой степени (серозная карцинома высокой степени злокачественности) злокачественности [13, 15].
D. Cundell и соавт. первыми сообщили об обнаружении мутации BRAF в серозной пограничной опухоли яичка; мутация KRAS не была выявлена [5]. В исследовании P. Gwiti и соавт. мутации BRAF и/или KRAS обнаружены в 3 из 7 случаев, что аналогично пропорциям, зарегистрированным при серозных новообразованиях яичников низкой степени злокачественности. В 1 из этих 3 случаев наблюдалась коммутация BRAF и KRAS [7]. Данные результаты подтверждают роль аберрантной передачи сигналов пути MAPK в патогенезе серозных опухолей яичка низкой степени злокачественности аналогично одноименным опухолям яичников.
Поскольку серозные опухоли яичка и придатка являются крайне редкими, во всем мире имеется минимальный клинический опыт лечения данных опухолей, ввиду чего не достигнуто консенсуса в отношении рекомендаций по их лечению. Выполнение радикальной орхэктомии рекомендовано пациентам с пограничной серозной опухолью. Считается, что данная опухоль характеризуется благоприятным прогнозом. Не было зарегистрировано случаев метастазирования. Однако, учитывая редкую встречаемость этой опухоли у мужчин и, как следствие, невозможность формирования достоверного суждения о ее прогнозе ввиду малого количества зарегистрированных на сегодняшний день во всем мире случаев по данным доступной литературы, необходимо тщательное многолетнее наблюдение за пациентами с серозной пограничной опухолью яичка.
Заключение
Пограничные тестикулярные эпителиальные опухоли яичникового типа являются чрезвычайно редкими и недостаточно изученными. Несмотря на это, нельзя забывать об их возможном инвазивном росте и склонности к рецидиву. Этот факт должен учитываться при дифференциальной диагностике необычных кистозных поражений яичка, мезотелиом или карцином яичка. Иммуногистохимическое исследование следует признать эффективным инструментом в обнаружении данного типа опухолей. Поскольку в имеющихся руководствах нет четких рекомендаций по лечению и ведению пациентов с пограничными тестикулярными опухолями яичникового типа, важно обмениваться опытом их обнаружения и лечения.
Литература
1. WHO Classification of Tumours Editorial Board. Urinary and male genital tumours. WHO Classification of Tumours Series, 5th edn., vol. 8. Lyon (France): International Agency for Research on Cancer, 2022. Available at: https://publications.iarc.fr/610.
2. Lin M.S., Ayala A.G., Ro J.Y. Ovarian-type tumors (Mullerian tumors) of the testis: clinicopathologic findings with recent advances. Ann Urol Oncol 2019;2(1):36–45. Available at: https://doi.org/10.32948/auo.2019.03.07
3. Aravind S., Nayanar S.K., Varadharajaperumal R. et al. High grade serous cystadenocarcinoma of testis-case report of a rare ovarian epithelial type tumour. J Clin Diagn Res 2017;11(6):ED13–5. DOI: 10.7860/JCDR/2017/27743.10097
4. Tickoo S.K., Paner G.P., Zhou M. et al. Protocol for the examination of radical orchiectomy specimens from patients with malignant germ cell and sex cord-stromal tumors of the testis. Version: 4.1.0.1.
5. Cundell D., Pawade J., Sohail M., Melegh Z. The V600E BRAF mutation in a borderline serous tumour of the testis is genotypic evidence of similarity with its phenotypic ovarian counterpart. Histopathology 2015;67(1):142–4. DOI: 10.1111/his.12630
6. Algaba F., Mikuz G., Boccon-Gibod L. et al. Pseudoneoplastic lesions of the testis and paratesticular structures. Virchows Arch 2007;451(6):987–97. DOI: 10.1007/s00428-007-0502-8
7. Gwiti P., Vereczkey I., Cundell D. et al. The mutational frequency of BRAF and KRAS in low-grade serous testicular neoplasms-a case series. Histopathology 2017;71(5):686–92. DOI: 10.1111/his.13261
8. Hsieh A., Miller M., He W., Shin D. Serous borderline tumor of the testis and associated magnetic resonance imaging findings. Urol Case Rep 2017;14:30–2. DOI: 10.1016/j.eucr.2017.06.007
9. Cassidy F.H., Ishioka K.M., McMahon C.J. et al. MR imaging of scrotal tumors and pseudotumors. Radiographics 2010;30(3):665–83. DOI: 10.1148/rg.303095049
10. Bürger T., Schildhaus H.U., Inniger R. et al. Ovarian-type epithelial tumours of the testis: immunohistochemical and molecular analysis of two serous borderline tumours of the testis. Diagn Pathol 2015;10:118. DOI: 10.1186/s13000-015-0342-9
11. Fonseca D., Manasa P.L., Sharma R., Giridhar A. Borderline serous papillary tumor of the testis. Indian J Pathol Microbiol 2020;63(4):618–9. DOI: 10.4103/IJPM.IJPM_837_19
12. Mayr D., Hirschmann A., Lohrs U., Diebold J. KRAS and BRAF mutations in ovarian tumors: a comprehensive study of invasive carcinomas, borderline tumors and extraovarian implants. Gynecol Oncol 2006;103(3):883–7. DOI: 10.1016/j.ygyno.2006.05.029
13. Kurman R.J., Shih I. Molecular pathogenesis and extraovarian origin of epithelial ovarian cancer--shifting the paradigm. Hum Pathol 2011;42(7):918–31. DOI: 10.1016/j.humpath.2011.03.003
14. Emmanuel C., Chiew Y.E., George J. et al. Genomic classification of serous ovarian cancer with adjacent borderline differentiates RAS pathway and TP53-mutant tumors and identifies NRAS as an oncogenic driver. Clin Cancer Res 2014;20(24):6618–30. DOI: 10.1158/1078-0432.CCR-14-1292
15. Shih I., Kurman R.J. Ovarian tumorigenesis: a proposed model based on morphological and molecular genetic analysis. Am J Pathol 2004;164(5):1511–8. DOI: 10.1016/s0002-9440(10)63708-x
1. WHO Classification of Tumours Editorial Board. Urinary and male genital tumours. WHO Classification of Tumours Series, 5th edn., vol. 8. Lyon (France): International Agency for Research on Cancer, 2022. Available at: https://publications.iarc.fr/610.
2. Lin M.S., Ayala A.G., Ro J.Y. Ovarian-type tumors (Mullerian tumors) of the testis: clinicopathologic findings with recent advances. Ann Urol Oncol 2019;2(1):36–45. Available at: https://doi.org/10.32948/auo.2019.03.07
3. Aravind S., Nayanar S.K., Varadharajaperumal R. et al. High grade serous cystadenocarcinoma of testis-case report of a rare ovarian epithelial type tumour. J Clin Diagn Res 2017;11(6):ED13–5. DOI: 10.7860/JCDR/2017/27743.10097
4. Tickoo S.K., Paner G.P., Zhou M. et al. Protocol for the examination of radical orchiectomy specimens from patients with malignant germ cell and sex cord-stromal tumors of the testis. Version: 4.1.0.1.
5. Cundell D., Pawade J., Sohail M., Melegh Z. The V600E BRAF mutation in a borderline serous tumour of the testis is genotypic evidence of similarity with its phenotypic ovarian counterpart. Histopathology 2015;67(1):142–4. DOI: 10.1111/his.12630
6. Algaba F., Mikuz G., Boccon-Gibod L. et al. Pseudoneoplastic lesions of the testis and paratesticular structures. Virchows Arch 2007;451(6):987–97. DOI: 10.1007/s00428-007-0502-8
7. Gwiti P., Vereczkey I., Cundell D. et al. The mutational frequency of BRAF and KRAS in low-grade serous testicular neoplasms-a case series. Histopathology 2017;71(5):686–92. DOI: 10.1111/his.13261
8. Hsieh A., Miller M., He W., Shin D. Serous borderline tumor of the testis and associated magnetic resonance imaging findings. Urol Case Rep 2017;14:30–2. DOI: 10.1016/j.eucr.2017.06.007
9. Cassidy F.H., Ishioka K.M., McMahon C.J. et al. MR imaging of scrotal tumors and pseudotumors. Radiographics 2010;30(3):665–83. DOI: 10.1148/rg.303095049
10. Bürger T., Schildhaus H.U., Inniger R. et al. Ovarian-type epithelial tumours of the testis: immunohistochemical and molecular analysis of two serous borderline tumours of the testis. Diagn Pathol 2015;10:118. DOI: 10.1186/s13000-015-0342-9
11. Fonseca D., Manasa P.L., Sharma R., Giridhar A. Borderline serous papillary tumor of the testis. Indian J Pathol Microbiol 2020;63(4):618–9. DOI: 10.4103/IJPM.IJPM_837_19
12. Mayr D., Hirschmann A., Lohrs U., Diebold J. KRAS and BRAF mutations in ovarian tumors: a comprehensive study of invasive carcinomas, borderline tumors and extraovarian implants. Gynecol Oncol 2006;103(3):883–7. DOI: 10.1016/j.ygyno.2006.05.029
13. Kurman R.J., Shih I. Molecular pathogenesis and extraovarian origin of epithelial ovarian cancer--shifting the paradigm. Hum Pathol 2011;42(7):918–31. DOI: 10.1016/j.humpath.2011.03.003
14. Emmanuel C., Chiew Y.E., George J. et al. Genomic classification of serous ovarian cancer with adjacent borderline differentiates RAS pathway and TP53-mutant tumors and identifies NRAS as an oncogenic driver. Clin Cancer Res 2014;20(24):6618–30. DOI: 10.1158/1078-0432.CCR-14-1292
15. Shih I., Kurman R.J. Ovarian tumorigenesis: a proposed model based on morphological and molecular genetic analysis. Am J Pathol 2004;164(5):1511–8. DOI: 10.1016/s0002-9440(10)63708-x